24 атом Модел RD (ядрена или планетарен модел атом)
Scattering индивидуален α-chastitsna uglyRezerfordobyasnil голям, така че положителния заряд в атом не е разпределена равномерно в радиуса на топка 10 -10 m. Както вече приема и се концентрира под централната част на един атом (атомно ядро) в много по-малки размери. Rutherford Изчисленията показват, че за обяснение експерименти α разсейващия частици трябва да радиуса на атомното ядро от около 10 -15 m.
P
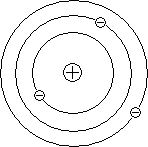
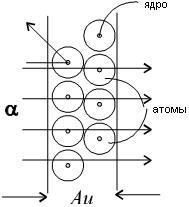
Планетарното модел на атома обяснява основните закони на разсейване на заредени частици.
Тъй като повечето от пространството в атом между атомното ядро и електрони циркулира около празните бързо заредените частици може почти свободно проникне сравнително големи сегменти от вещества, съдържащи няколко хиляди атомни слоеве.
В сблъсъци с отделни електрони бързо заредени частици са разпръснати по много големи ъгли, тъй като масата на електрони е малък. Въпреки това, в тези редки случаи, когато бързо заредена частица летене на много близко разстояние от един от атомните ядра под действие на електрическо поле на атомното ядро на зарежда разсейване на частиците може да се случи във всеки ъгъл до 180 °.
25 постулати на Бор
Първият квантовата теория на атома byda предложен през 1913 г. от датския физик Нилс Бор. Тя се основава на модел ядрената атом, според която атом състои от положително заредени сърцевина, около която отрицателно заредените електрони. теория на Бор се основава на два постулата.
Ipostulat Бора - постулат на стационарни състояния. В атома има стационарна (не се променят с течение на времето) състоянието, в което тя не излъчва енергия. Тези стационарни състояния съответстват стационарна орбита, чрез които да се движат електрони. Движението на електроните по стационарните орбити не е придружен от радиация.
IIpostulat Бор, наречен "правило на честоти". В прехода на електрон от една орбита в друга неподвижна излъчваната (или абсорбира) квант енергия, равна на разликата между енергия стабилни състояния
където ч - Планк константа; V - излъчване честота (или поглъщане) на енергия; HV - фотонна енергия (или поглъщане); En и Ем - енергията на стационарни състояния на атома, преди и след емисии (усвояване), съответно. най-Em
В Бор стойност теория електрон енергия, равна на водороден атом
където ме - електрон маса, д - електронен заряд, εe - диелектрична константа. Н - константа на Планк, п - число, п = 1,2,3.
По този начин, енергията на електрон на атом е дискретна стойност, която може да се променя само с прекъсване.
Наборът от възможните дискретни честоти квантовата преходи определя линия спектър атом
Изчислена чрез тази формула за честотата на спектралните линии на водороден атом са в отлично съгласие с експерименталните данни. Но теорията не е спектрите на други атоми, са обяснени (дори след водород хелий). Ето защо, теория на Бор е само преходен етап по пътя на изграждането на теорията за атомните явления. Тя посочи неприложимостта на класическата физика към вътрешноатомното явления и върховенството на законите за квантовата за микрокосмоса.
26 принципа на Паули
През 1925 г. Паули създадена квантовата - механичен принцип (Принцип на Паули).
Всеки атом не може да бъде два електрона в идентични стационарни състояния, определени от набор от четири квантово число: п. т, MS.
Например, нивото на енергия може да бъде не повече от два електрона, но с обратна посока на завъртания.
Принципът на Паули е активирал теоретична основа на периодична система на Менделеев на елементи за създаване на квантовата статистика, съвременната теория за твърди частици и др.
Състоянието на всеки електрон на атом се характеризира с четири квантово число:
1. главно квантово число (п = 1, 2).
2. Orbital (азимута) квантовата номер L (L = 0, 1, 2. п-1).
3. магнитно квантово число М (m = 0, +/- 1, +/- 2, +/-. +/- л).
4. Spin квантово число MS (Ms = +/- 1/2).
За фиксирана стойност на основната квантовата броя н съществува 2n2 различни квантови състояния на електрона.
Един от законите на квантовата механика, наречени принципа на Паули изключване, гласи:
В един и същи атом, не може да бъде два електрона със същия набор от квантови числа (т.е. не може да бъде два електрона в същото състояние).
принцип Pauli обяснява периодични повторяеми свойства атом, т.е. Периодична система на елементите на Менделеев система.
Периодичната система на елементите, D. I. Mendeleeva
През 1869 г. Менделеев открива периодичния закон на изменение на химичните и физичните свойства на елементите. Той въвежда понятието за атомен номер и получава пълна периодичност в химичните свойства на елементите.
Менделеев предсказал редица нови елементи (скандий, германий, и т.н.) и е описано техните химични свойства. По-късно тези елементи са открили, че напълно потвърди валидността на теорията си. Дори и да успее да се усъвършенства на стойностите на атомните тегла на някои свойства на елементите.
Химичните свойства на няколко атома и техните физични свойства са обяснени от поведението на външния (валентност) електрона.
Стационарна квантово състояние на електрон на атом (молекула) се характеризира с набор 4 квантово число: главен (п), орбитален (л), магнитна (т) и магнитна въртене (MS). Всеки от тях се характеризира Quantization: мощност (п), ъгловата скорост (L), ъгловата скорост в посоката на външно магнитно поле (т) и завъртане издатина (MS).
Според теорията на номера на последователност на химичен елемент Z е общият брой на електрони в атома.
Ако Z - броя на електроните в атом е в състояние, което се определя от набор 4 квантово число п, L, M, MS, тогава Z (М, L, M, MS) = 0 или 1.
Ако Z - броя на електроните в атома в страни, определени от набор от 3 квантово число N, L, M, тогава Z (М, L, M) = 2. Такива електрони са различни въртене ориентация.
Ако Z - броя на електроните в един атом са в състояния, определени от 2 квантово число п, L, тогава Z (п л) = 2 (2л + 1).
Ако Z - броя на електроните в атома, които са в състояния, определени от стойността на основната квантово число п, тогава Z (п) = 2n2.
Електроните в един атом заемат същия набор от състояния с главно квантово число, образуват електронен слой: когато п = 1 К - слой; когато п = 2 L - слой; когато п = 3, М - слой; когато п = 4, N - слой; когато п = 5 O - слой и т.н.
Във всяка от всички електроните са разпределени електронни черупки на атом слой. Черупката съответства на определена стойност на орбитално квантово число (таблица. 1 и фиг. 1).
L За даден магнитен квантово число m отнема 2L + 1 ценности и MS - две стойности. Следователно, броят на възможните състояния в електронен облак с предварително л е 2 (2л + 1). Тъй като обвивка л = 0 (S - обвивка) е изпълнен с две електрони; обвивка л = 1 (р - черупка) - шест електрони; обвивка L = 2 (г - черупка) - десет електрони; обвивката 3 л = (F - черупка) - четиринадесет електрони.
Последователност на слоеве и пълнене на електронен слой в периодичната система на елементите, се обяснява с квантовата механика и въз основа на 4-позиции:
1. Общият брой на електроните в атома на химичния елемент е равна на поредния номер на Z.
2. състоянието на електрона в атома се определя избран 4 квантово число; N, L, M, MS.
3. Разпределението на електроните в атома на енергийните състояния, трябва да отговарят минимум енергия.
4. Попълване електрон енергийни състояния в атома трябва да са в съответствие с принципа на Паули изключване.
При разглеждане на атоми с голяма Z, поради увеличаването на ядрен заряд, електронен слой е сключен договорът за ядрото и започва да запълнят слоя с п = 2 и т.н. Когато предварително определено условие е първият напълнена с п S-електрони (L = 0), след това р-електрони (л = 1), D-електрони (L = 2), и т.н. Това води до периодичността на химични и физични свойства на елементите. За първи елемент на първия период е изпълнен 1s обвивка; електрони за втория и третия периоди - черупки 2s, 2P и 3p и 3 мастни киселини.
Въпреки това, тъй като четвъртия период (елемент калий, Z = 19), последователността на пълнене на черупките е прекъсната поради конкуренция с подобен електрон свързваща енергия. Може да бъде по-силни (енергично благоприятни), свързани електрони с голям п, но по-малка от L (например, електрони 4s силна обвързани от 3D).
Разпределението на електрони в атома на черупките определи своята електронна конфигурация. За да зададете конфигурация е-атом е написано в редица символи, пълни електронни обвивки се посочва, NL, като се започне с най-близките до мозъка на костите. горния десен Index отбележат броя на електроните в обвивката намира в тези държави. Например, натриев атом 2311Na където Z = 11 - серийния номер на елемента в периодичната таблица; броя на електроните в атома; броя на протоните в ядрото; А = 23 - масово число (брой протони в ядрото и неутрони). Електронна конфигурация изглежда така: 1s2 2s2 2p6 3s1, т.е. в слой с п = 1 и L = 0 - на два S-електрона; в слой с п = 2 и L = 0 - на два S-електрона; в слой с п = 2 и L = 1 - р шест електрони; в слой с п = 3 и L = 0 - на S-електрон.
Заедно с нормална електронен атом конфигурация, съответстваща на най-силно свързване енергия на електроните в възбуждане на един или повече електрони с възбуден електронен конфигурация.
Например, всички нива на хелий енергия се разделят на две нива на системата: нивата на система parahelium съответстващи на антипаралелни ориентацията на завъртания на системата orthohelium нива, съответстващи на паралелна ориентация на електрони и завъртания. Нормално 1s2 хелий конфигурация поради принципа на Паули изключване е възможно само когато антипаралелен ориентацията на електрона завъртания съответния parahelium.
Така че ние се заключи, принципа на Паули изключване обяснява, отдавна е смятан за мистериозен, периодични структурни елементи, открит D.I.Mendeleevym.chenie