Теоретичната част
Алкилирането - е процес за въвеждане на алкилови групи в молекулата на органичната и някои неорганични вещества
Всички алкилиращи агенти от типа на връзка, ги спукването на алкилиране да бъдат разделени в следните групи:
1) ненаситени съединения, олефини и ацетилен, в които се появява съобщение PI- празнина.
С оглед на ниската цена, която се опитват да използват във всички случаи, когато това е възможно. Основното приложение са намерили за C-алкилиране на парафини и ароматни съединения. В реакциите на О- и N-алкилиране и синтеза на много органометални съединения олефини неефективни. Олефините реагират с парафини или ароматен форма YZ-levodorodami съответно парафини или верига алкилбензени разклонени:
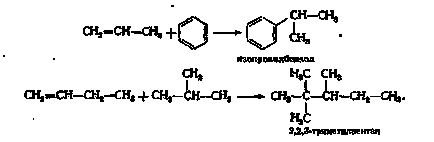
Реактивността на олефин-образуването зависи от йони способността на въглеродни:
Удължение и разклоняване на въглеродната верига подобрява способността за алкилиране, като по този начин по-малко способни да алкилиране на етилен.
2) хлорни производни с достатъчно лабилна хлорен атом и може да се измества под влияние на различни средства. Се хлорира алкилиращи агенти, които са подходящи за S, О, С, N - алкилиране. Тяхната алкилиращо действие се различава в три различни взаимодействия:
Използването на хлорирана рационално за тези процеси, в които е невъзможно да се замени хлорирани олефини или когато по-евтини и по-достъпни олефини.
Хлорирани алкилиращо действие се проявява в три различни видове взаимодействия:
а) електрофили в реакции характерни предимно за алкилиране на въглероден атом, но за разлика от тези на олефини катализирана реакция само апротонни киселини (хлориди на алуминий, желязо и т.н.). Процесът протича с междинно образуване на карбониев йон, както следва:
б) чрез нуклеофилно заместване. характеристика главно за алкилиране на кислородни атоми, сяра, азот, протича процес, както следва:
в) свободни радикали процес е особено характерно за organoelement и органометални съединения, където свободните радикали се образуват в резултат на взаимодействието с метали.
3) алкохоли, етери, алфа-двуалуминиев триокис, т.е. съединения, в които разгражда CO връзка. Алкохоли и етери са способни реакции С 0-, N - и S-алкилиране. За да включват етери и олефин оксид са вътрешни естери на гликоли и етери на всички по същество само олефин оксид, използван като алкилиращи средства. Тези средства се използват в случаите, когато те са по-евтини и по-достъпни хлорни производни. За да се прекъсне тяхната алкил-кислород връзка изисква киселина тип катализатори:
4) естери на сярна киселина и арилсулфонови киселини. Тези реакции често се появяват с разкъсване алкил-кислород връзка, което води до алкилиращи естери действие.
Като алкилиращи средства се използват главно, и хлорирани олефини. Използването на алкохоли е по-малко ефективно, тъй като алкилиране на алкохоли разлагане на алуминиев хлорид и протната киселина се разрежда с вода образува. И в двата случая катализатор деактивиране възниква, което причинява висока консумация.
Процес катализатори са: протонна (сярна, ортофосфорна, флуороводородна киселина, алуминосиликати, цеолити) или апротични (халогениди на преходни елементи, алуминиев хлорид) киселина.
реакции механизъм C-алкилиране (например арени), когато катализаторът е апротонен киселина (алуминиев хлорид), се състои от следните етапи:
а) образуване на карбониев iona- алкилиране:
- хлоро производно се дължи на активирането на хлорен атом и образуват силно поляризиран комплекс
;
- олефини се появява само в присъствието на съкатализатор - хидрохлоридна:
.
б) други карбониев йон (или силно поляризирани комплекс получената начин или) след напада ароматния пръстен с реакцията протича през междинно съединение-Pi комплекс и карбониев йон, последвано от бързо стъпка разцепване протон:
където + е С2 Н5 или R-CH + -СН3
реакции механизъм C-алкилиране (например парафин) олефини като катализатори са протонни киселини (сярна киселина), се състои от следните етапи:
а) Получаване на въглеродни йони, е както следва: H 2SO 4 → Н + + Н, SO4 -
въглеродни йони, може след това да бъде изомеризирани от миграцията на водородни атоми и метилови групи:
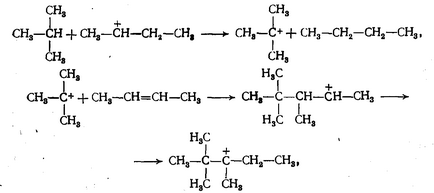
Механизъм възможни реакции радикални С-алкилиране (например парафин) олефини инициатори под влиянието на светлина или топлина, която се състои от следните етапи:
а) образуване на свободни радикали. Под влияние на топлината-ем настъпва homolytic отцепване на С-С връзки в молекулата и парафин образуването на свободен RA-дикалит на:
б) растеж верига. Чрез взаимодействие с свободен радикал изопарафин (за-пример, изобутан), оформен парафин и други свободни радикали:
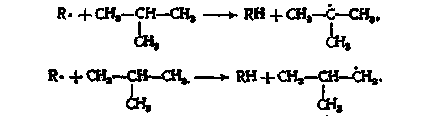
Освен третичен радикал е оформен с висока скорост, и първичната изобутил радикал - е много по-бавно. Терт-бутилов радикал след това е свързан към етилен съобщението двойната и дава неохексил радикал, че при сблъсък с изобутан и нови форми neohexane трет-бутилов радикал:
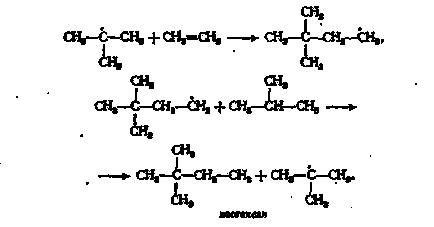
в) Open верига. Това се случва, когато vzaisodeystvii два радикала R * или чрез взаимодействие с N # 8729;
процеси Класификация алкилиране в зависимост от вида на новосформираната връзката е както следва:
А) Алкилиране на въглеродния атом (С - алкилиране) Същността се състои в заместване на Н2 атом. при С, алкилова група, по този начин може да се получи изопарафини.
.. В) Алкилиране на кислородни атоми, тя се нарича О-алкилирането, т.е. метод на заместване на водородни атоми с един кислороден атом в органични съединения до алкилна група:
-Този процес може да бъде представено чрез следната верига на трансформации:
а) Аг-ОН + NaOH → Ar-ONa + Н 2О
б) R-CI + Ar-ONa → NaCl + Ar-O-R
B) Алкилирането на серни атоми се нарича S - алкилиране, т.е. метод на заместване на водородни атоми на серен атом в алкилова група:
R-CI + NaSH → HCl + НСРС
F) Алкилирането на азотни атома, той се нарича N - алкилиране, т.е. метод на заместване на водородни атоми в амоняк или амини в алкиловата група:
. Е) Алкилиране на атоми на други елементи (Si- Pb, A1-алкилиране) е основен начин за получаване elementoorganic и органометални съединения, където алкиловата група е директно свързан към хетероатом: